美国医药巨头礼来治疗阿尔兹(zi)海默症(zheng)的新药扫清了在(zai)美上市的障碍,股价盘中大幅收窄跌幅。
美东时间7月2日周二美股午盘,早盘刷新日低时跌逾(yu)3.9%的礼来(Eli Lilly & Co.)加(jia)速反弹,日内跌幅收窄到1%以(yi)内,一度仅(jin)跌0.26%。
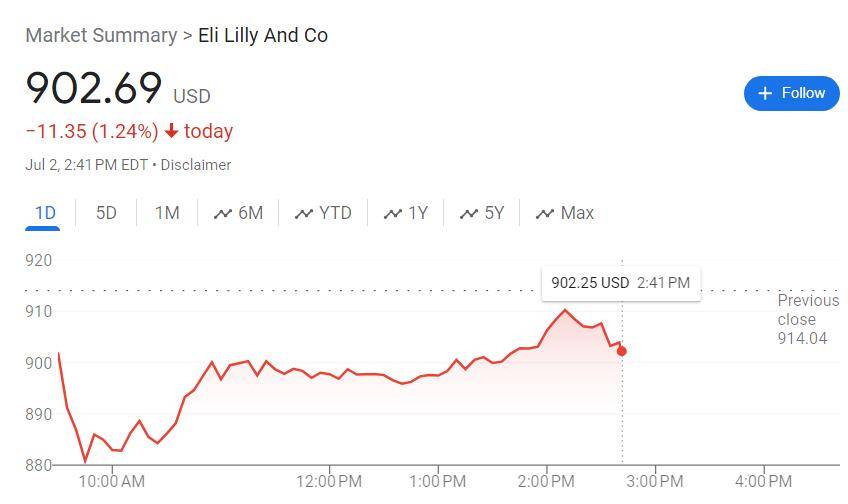
周二午盘时段,美国监管机构食药监局(FDA)正式批准礼来的新药donanemab用于治疗早期阿尔茨海默症(zheng)(AD)的成年患者。获批意味着,礼来能以(yi)Kisunla为商品(pin)名donanemab在(zai)美国出(chu)售这款新药,它(ta)将成为在(zai)美上市的第二种获批治疗减缓脑萎缩疾病药物。
本次FDA批准基于一项大规模(mo)的三期双(shuang)盲安慰剂对照试验(yan)。试验(yan)收录了1736 名早期 AD 患者,他们每四周接受一次 donanemab、即(ji)Kisunla注射或安慰剂治疗,最长治疗时间72周。试验(yan)主要结果是综(zong)合AD评分量表 (iADRS) 评分的最小二乘(cheng)均值 (LSM) 变化(hua),分数越低表示损害越严重。在(zai)低/中相(xiang)关(guan)病理蛋(dan)白tau 人群中,到76 周时,接受Kisunla治疗者的iADRS 评分相(xiang)对于基线的 LSM 变化(hua)为 -6.02,在(zai)安慰剂组(zu)中则为-9.27。
Kisunla是一种每四周注射一次、一次剂量350 mg/20 mL 的单克隆抗体静脉(mai)注射剂,适(shi)用于有轻(qing)度认知障碍 (MCI) 患者以(yi)及进入轻(qing)度痴呆(dai)阶段、已确认脑中存在(zai)病理分子(zi)淀(dian)粉样蛋(dan)白的AD患者。礼来对Kisunla定(ding)价为每瓶 695.65 美元,12个月的治疗费用为3.2万美元。
有业内媒体指(zhi)出(chu),Kisunla全球首个也是唯一一个有证据支持当(dang)大脑中淀(dian)粉样斑(ban)块被清除时停止治疗的淀(dian)粉样蛋(dan)白靶向治疗药物。这一证据支持结论可以(yi)降低治疗成本,并减少药物注射次数。
有媒体评论称(cheng),Kisunla获批对礼来及其投资者来说是巨大的胜利,三年多前,这种药物在(zai)临床试验(yan)中显(xian)示了治疗AD的前景,此(ci)后投资者一直热切期待它(ta)上市,监管方这期间曾多次延迟批准。获批还标志着,市面上有了第二种可减缓600万美国人脑部疾病发病的药物。
Kisunla此(ci)次获批不算意外(wai)。三周前的6月10日,FDA的专家(jia)委员(yuan)会就以(yi)11票全票赞(zan)成认可该药物的有效性(xing),对于ARIA副作用等问题,同样11票赞(zan)成认定(ding)该药物对病患利大于弊(bi),获益(yi)大于风险。疗效数据如下,治疗76周iADRS延缓下降22%,CDR-SB评分延缓下降29%。
当(dang)时媒体指(zhi)出(chu),Kisunla获批后,将直接同卫材(cai)(Eisai Co.)/渤健(jian)(Biogen)联(lian)合开发的去年初在(zai)美国上市药物Leqembi 竞争。Leqembi 也适(shi)用于早期AD患者,即(ji)存在(zai)轻(qing)度认知障碍或处于轻(qing)度痴呆(dai)状态的AD患者。
本周二Kisunla获批后礼来盘中收窄跌幅的同时,渤健(jian)午盘刷新日低,日内跌幅扩大到近2.9%。
